|
|
| |
|
| |
CONTRÔLE INHIBITEUR DIFFUS (CIDN) |
|
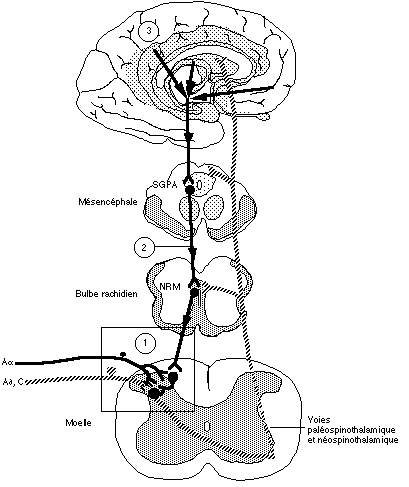
L'effet analgésique de la stimulation des zones gâchettes à l'aide de balles s'explique par le mécanisme de contrôle inhibiteur diffus induit par des stimulations nociceptives. Un système inhibiteur descendant module aussi la douleur (figure 2.7). Contrairement à la théorie du portillon, ce type d'inhibition provient des stimulations nociceptives qui activent un système descendant mettant en jeu la substance grise périaquéducale, le noyau raphé magnus et les cornes postérieures de la moelle (14, 101). Selon ce modèle, une stimulation des fibres à petit diamètre déclenche, vers les neurones nociceptifs des couches I et V des cornes postérieures de la moelle, un système d'inhibition descendant issu de la substance grise périaquéducale et du noyau raphé magnus. Cette activité analgésique est connue sous le nom de CIDN ou Contrôles Inhibiteurs Diffus induits par des stimulations Nociceptives (207,208). Ces stimulations activent les neurones du bulbe rostro-ventral qui inhibent à leur tour l'activité des neurones nociceptifs des cornes dorsales de la moelle. Contrairement au système de modulation proposée par la théorie du portillon, le CIDN produit une inhibition descendante qui ne se limite plus à la région stimulée (83, 354,355). L'application d'un stimulus nociceptif intense active le pool de neurones nociceptifs non spécifiques correspondant au segment médullaire activé, tout en inhibant simultanément des neurones du même type situés ailleurs dans la moelle épinière. En réduisant l'activité des neurones nociceptifs non-spéciques, les CIDN atténueraient le bruit de fond et feraient ressortir l'activité des neurones spécifiques sollicités par la stimulation nociceptive (209). Selon cette hypothèse, la douleur ne serait pas uniquement déclenchée par des processus excitateurs, mais par la perception d'un contraste entre les activités de deux pools de neurones (27). Ce modèle explique bien l'inhibition généralisée de la douleur produite par des stimulation intenses, voire pénibles. Dans le système inhibiteur descendant, le blocage de la réponse nociceptive se produit dans trois zones différentes. D'abord, dans la région du mésencéphale où une stimulation au niveau de la substance grise périaquéducale amène une inhibition du message nociceptif sans influencer la transmission des autres messages. Une stimulation de la substance grise péri-ventriculaire de l'hypothalamus produit également le même effet (ces deux sites sont anatomiquement reliés). L'information parvenant au mésencéphale arrive principalement de la partie antérieure du bulbe, de la moelle épinière et du lobe frontal. L'information provenant de la moelle joue ici un rôle prépondérant. Ensuite, l'inhibition de la réponse nociceptive peut se produire dans la région rostro-ventrale du bulbe. Cette région comprend notamment le noyau raphé magnus et la formation réticulée du bulbe. Elle reçoit ses informations principalement de la substance grise périaquéducale et de la formation réticulée adjacente au mésencéphale. Enfin, l'inhibition du message nociceptif se produit aussi dans la région latérale et dorso-latérale de la protubérance annulaire. Peu étudiée, cette zone territoire envoie des projections vers la substance grise périaquéducale, la partie rostro-ventrale du bulbe et la moelle épinière. Le funicule dorso-latéral constitue le relais descendant entre les deux régions mentionnées et la moelle épinière. Toutefois, peu de projections directes relient la substance grise périaquéducale et le funicule dorso-latéral. La majeure partie de l'information passe probablement d'abord par la partie rostro-ventrale du bulbe avant de rejoindre les lames I, II et V de la moelle via le funicule dorso-latéral (100).
Deux neurotransmetteurs participent au contrôle exercé par le système inhibiteur descendant : les transmetteurs biogéniques aminés et les opiacés. Dans le cas des transmetteurs aminés, les projections issues de la région rostro-ventrale du bulbe comprennent des neurones sérotoninergiques. Les zones issues de la région pontine tegmentum contiennent des neurones noradrénergiques. Leur action médullaire est rendue possible par des récepteurs adrénergiques alpha2 concentrés dans les lames supérieures de la moelle. À l'évidence, la sérotonine, issue des neurones sérotoninergiques, agit directement sur les neurones de la corne dorsale pour les inhiber. Pour leur part, les opiacés figurent parmi les analgésiques connus les plus puissants. Leur efficacité s'explique en grande partie par les récepteurs opiacés spécifiques contenus dans certaines synapses des lames supérieures de la corne dorsale, de la substance grise périaquéducale et probablement aussi de la substance grise rostro-ventrale du bulbe, une région moins bien étudiée. D'un autre côté, certains neurones renferment des dérivés d'opiacés libérables lorsque la situation le requiert. Les concentrations les plus marquées d'enképhalines se trouvent dans le système nerveux sympathique, l'intestin et les cellules chromaffines des surrénales. Les dynorphines, retrouvées aux mêmes endroits mais dans des cellules différentes, et les endorphines-ß en contiennent aussi. Il reste encore à découvrir au niveau des mécanismes assurant le fonctionnement des contrôles descendants. De nombreux neurotransmetteurs, dont plusieurs peptides, ont été identifiés particulièrement au niveau de la colonne dorsale. Certains d'entre eux y jouent probablement un rôle inhibiteur. Ainsi, les neurones sérotoninergiques agissent directement et de façon postsynaptique sur les cellules de la corne dorsale. Ils influencent aussi des interneurones contenant des enképhalines qui, en retour, interviennent post-synaptiquement sur les cellules de la corne dorsale. De plus, la terminaison centrale de plusieurs afférents primaires possède des récepteurs opiacés. Ainsi l'interneurone contenant des enképhalines pourrait agir, de façon présynaptique, sur l'afférent primaire en limitant la décharge transmise à la cellule de la corne dorsale. L'application de stimuli prolongés et intenses déclenchent l'action analgésique des opiacés. Mais le stress, la peur ou l'anxiété la favorisent encore davantage ! |